Protein (hay còn gọi là chất đạm) là một trong những thành phần không thể thiếu trong cơ thể động thực vật. Nó là dưỡng chất quan trọng mà cơ thể cần bổ sung hàng ngày, từ đó duy trì sự sống và tăng cường sức khỏe cho con người. Tuy nhiên bạn biết bao nhiêu về protein? Protein cụ thể là gì? Cùng Mela tìm hiểu ngay nhé!
Protein là gì?
Protein là các phân tử sinh học và các đại phân tử bao gồm một hoặc nhiều chuỗi dài axit amin.
Protein thực hiện rất nhiều chức năng bên trong sinh vật, bao gồm:
- Xúc tác các phản ứng trao đổi chất
- Sao chép DNA
- Phản ứng với các kích thích
- Cung cấp cấu trúc cho tế bào và sinh vật
- Vận chuyển các phân tử từ vị trí này sang vị trí khác.
Axit amin
Các protein chủ yếu khác nhau ở trình tự các axit amin, trình tự này được quy định bởi trình tự nucleotit trong gen của chúng và thường dẫn đến việc protein gấp lại thành một cấu trúc 3D cụ thể xác định hoạt động của nó.
Cấu trúc protein
Một chuỗi thẳng của dư lượng axit amin được gọi là polipeptit. Một protein chứa ít nhất một polypeptit dài. Các polypeptit ngắn, chứa ít hơn 20–30 gốc, hiếm khi được coi là protein và thường được gọi là peptit.
Các gốc axit amin riêng lẻ được liên kết với nhau bằng liên kết peptit và các gốc axit amin liền kề. Trình tự của các axit amin trong protein được xác định bởi trình tự của một gen, được mã hóa trong mã di truyền.
Mã di truyền
Nói chung, mã di truyền quy định 20 axit amin tiêu chuẩn. Tuy nhiên ở một số sinh vật, mã di truyền có thể bao gồm selenocysteine hay ở một số vi khuẩn cổ là pyrrolysine.
Ngay sau khi hoặc thậm chí trong quá trình tổng hợp, các phần còn lại trong protein thường bị biến đổi về mặt hóa học do biến đổi sau dịch mã, làm thay đổi các tính chất vật lý và hóa học, sự gấp nếp, tính ổn định, hoạt động, và cuối cùng là chức năng của protein.
Một số protein có các nhóm không phải peptit được gắn vào, có thể được gọi là nhóm giả hoặc đồng sáng lập. Các protein cũng có thể hoạt động cùng nhau để đạt được một chức năng cụ thể. Chúng thường liên kết với nhau để tạo thành các phức hợp protein ổn định.
Sau khi được hình thành, protein chỉ tồn tại trong một thời gian nhất định, sau đó bị phân hủy và tái chế bởi bộ máy của tế bào thông qua quá trình luân chuyển protein. Tuổi thọ của protein được đo bằng thời gian bán hủy của nó và bao trùm một phạm vi rộng. Chúng có thể tồn tại trong vài phút hoặc nhiều năm với tuổi thọ trung bình là 1–2 ngày trong tế bào động vật có vú. Các protein bất thường hoặc bị sai lệch sẽ bị suy giảm nhanh hơn do bị nhắm mục tiêu để phá hủy hoặc do không ổn định.
Bộ phận thiết yếu
Giống như các đại phân tử sinh học khác như polysacarit và axit nucleic, protein là bộ phận thiết yếu của sinh vật, tham gia vào hầu hết mọi quá trình bên trong tế bào. Nhiều protein là các enzym xúc tác các phản ứng sinh hóa và rất quan trọng đối với quá trình trao đổi chất. Protein cũng có chức năng cấu trúc hoặc cơ học, chẳng hạn như actin và myosin trong cơ hay protein trong khung tế bào, tạo thành một hệ thống giàn giáo duy trì hình dạng tế bào.
Các protein khác rất quan trọng trong việc truyền tín hiệu tế bào, đáp ứng miễn dịch, kết dính tế bào và chu kỳ tế bào. Ở động vật, protein cần thiết trong chế độ ăn uống để cung cấp các axit amin thiết yếu không thể tổng hợp được. Tiêu hóa phá vỡ các protein để sử dụng trao đổi chất.
Protein được tinh chế từ các thành phần tế bào khác bằng nhiều kỹ thuật như:
- siêu ly tâm
- kết tủa
- điện di
- sắc ký (chromatography).
Sự ra đời của kỹ thuật di truyền đã tạo ra một số phương pháp tạo điều kiện cho thanh lọc. Các phương pháp thường được sử dụng để nghiên cứu cấu trúc và chức năng của protein gồm hóa mô miễn dịch, gây đột biến tại chỗ, tinh thể học tia X, cộng hưởng từ hạt nhân và khối phổ.
Lịch sử và từ nguyên
Lịch sử
Protein được Antoine Fourcroy và những người khác công nhận là một loại phân tử sinh học riêng biệt vào thế kỷ 18, được phân biệt bởi khả năng đông tụ hoặc tạo bông của phân tử khi xử lý bằng nhiệt hoặc axit.
Các ví dụ được chú ý vào thời điểm đó bao gồm
- Albumin từ lòng trắng trứng
- Albumin huyết thanh
- Fibrin
- Gluten lúa mì.
Mô tả
Protein lần đầu tiên được mô tả bởi nhà hóa học người Hà Lan Gerardus Johannes Mulder và được đặt tên bởi nhà hóa học Thụy Điển Jöns Jacob Berzelius vào năm 1838. Mulder đã tiến hành phân tích nguyên tố của các protein phổ biến và phát hiện ra rằng gần như tất cả các protein đều có cùng một công thức thực nghiệm C400H620N100O120P1S1 .Ông đã đi đến một kết luận sai lầm rằng chúng có thể gồm một loại phân tử (rất lớn).
Thuật ngữ “protein” để mô tả các phân tử này được người cộng sự của Mulder là Berzelius đề xuất. Protein có nguồn gốc từ tiếng Hy Lạp πρώτειος ( proteios ), có nghĩa là “chính”, “dẫn đầu”, hoặc “đứng trước”, + -in . Mulder tiếp tục xác định các sản phẩm thoái hóa protein chẳng hạn như axit amin leucine mà ông đã tìm thấy trọng lượng phân tử (gần đúng) 131 Da. Trước “protein”, các tên gọi khác đã được sử dụng như “albumin” hoặc “nguyên liệu tạo albumin” (Eiweisskörper trong tiếng Đức).
Từ nguyên
- Các nhà khoa học dinh dưỡng ban đầu như Carl von Voit (người Đức) tin rằng protein là chất dinh dưỡng quan trọng nhất để duy trì cấu trúc của cơ thể. Bởi người ta tin rằng “thịt tạo nên thịt”.
- Karl Heinrich Rittenhausen đã mở rộng các dạng protein đã biết bằng việc xác định axit glutamic.
- Tại Trạm thí nghiệm Nông nghiệp Connecticut, Thomas Burr Osborne đã biên soạn một đánh giá chi tiết về protein thực vật. Làm việc với Lafayette Mendel và áp dụng định luật Liebig về mức tối thiểu trong việc cho chuột thí nghiệm ăn, các axit amin thiết yếu về mặt dinh dưỡng đã được thiết lập.
- Công việc được tiếp tục và truyền đạt bởi William Cumming Rose. Sự hiểu biết về protein dưới dạng polypeptide là nhờ công trình của Franz Hofmeister và Hermann Emil Fischer vào năm 1902.
- Vai trò trung tâm của protein với tư cách là enzyme trong cơ thể sống không được đánh giá đầy đủ cho đến năm 1926, khi James B. Sumner chỉ ra rằng enzyme urease thực chất là một loại protein.
Khó khăn trong việc tinh chế protein với số lượng lớn khiến các nhà hóa sinh protein thời kỳ đầu rất khó nghiên cứu chúng. Do đó, các nghiên cứu ban đầu tập trung vào các protein có thể tinh chế với số lượng lớn, ví dụ như protein trong máu, lòng trắng trứng, các chất độc khác nhau và các enzym tiêu hóa/chuyển hóa thu được từ các lò mổ. Vào những năm 1950, Armor Hot Dog Co. đã tinh chế 1 kg ribonuclease tuyến tụy A nguyên chất của bò và cung cấp miễn phí cho các nhà khoa học. Hành động này đã giúp ribonuclease A trở thành mục tiêu chính cho nghiên cứu sinh hóa trong những thập kỷ tiếp theo.
Cấu trúc thứ cấp
Linus Pauling được ghi nhận với dự đoán thành công về cấu trúc thứ cấp thông thường của protein dựa trên liên kết hydro, một ý tưởng do William Astbury đưa ra lần đầu tiên vào năm 1933. Công trình sau đó của Walter Kauzmann về sự biến tính dựa một phần trên nghiên cứu trước đó. Các nghiên cứu của Kaj Linderstrøm-Lang đã đóng góp thêm vào những hiểu biết của con người về sự gấp nếp của protein và cấu trúc trung gian bởi các tương tác kỵ nước.
Protein đầu tiên được giải trình tự là insulin, bởi Frederick Sanger vào năm 1949. Sanger đã xác định chính xác trình tự axit amin của insulin. Do đó chứng minh một cách thuyết phục rằng protein bao gồm các polyme tuyến tính của axit amin chứ không phải chuỗi nhánh, chất keo hoặc cyclol. Ông đã đoạt giải Nobel cho thành tựu này năm 1958.

Mô hình Myoglobin
Sắp xếp cấu trúc
Với sự phát triển của tinh thể học tia X, người ta có thể sắp xếp các cấu trúc protein. Cấu trúc protein đầu tiên được giải quyết là hemoglobin của Max Perutz và myoglobin của John Kendrew vào năm 1958. Việc sử dụng máy tính và tăng sức mạnh tính toán cũng hỗ trợ việc giải trình tự các protein phức tạp. Năm 1999, Roger Kornberg đã thành công trong việc giải trình tự cấu trúc rất phức tạp của RNA polymerase bằng cách sử dụng tia X cường độ cao từ synchrotron.
Kể từ đó, kính hiển vi điện tử lạnh (cryo-EM) của các tổ hợp đại phân tử lớn đã được phát triển. Cryo-EM sử dụng các mẫu protein được đông lạnh thay vì tinh thể và chùm điện tử thay vì tia X. Nó gây ít thiệt hại hơn cho mẫu, cho phép các nhà khoa học thu được nhiều thông tin hơn và phân tích các cấu trúc lớn hơn. Dự đoán cấu trúc protein bằng máy tính của các miền protein nhỏ cũng đã giúp các nhà nghiên cứu tiếp cận độ phân giải cấu trúc protein ở cấp độ nguyên tử. Tính đến năm 2017, Ngân hàng Dữ liệu Protein có hơn 126.060 cấu trúc phân giải nguyên tử của protein.
Số lượng protein được mã hóa trong bộ gen
Số lượng protein được mã hóa trong một bộ gen tương ứng với số lượng gen (mặc dù có thể có một số lượng đáng kể các gen mã hóa RNA của protein, ví dụ như RNA ribosome). Virus thường mã hóa từ vài đến vài trăm protein, vi khuẩn cổ và vi khuẩn thì từ vài trăm đến vài nghìn. Trong khi đó sinh vật nhân thực thường mã hóa từ vài nghìn đến hàng chục nghìn protein.
Hóa sinh
Hầu hết các protein bao gồm các polyme tuyến tính được xây dựng từ chuỗi lên đến 20 axit amin L -α- khác nhau. Tất cả các axit amin tạo protein đều có các đặc điểm cấu trúc chung, bao gồm một α-cacbon mà một nhóm amin, một nhóm cacboxyl và một chuỗi bên biến đổi được liên kết cùng. Chỉ có proline khác với cấu trúc cơ bản này vì nó chứa một vòng bất thường đối với nhóm amin cuối N, buộc nhóm amit CO–NH thành một cấu trúc cố định.
Các chuỗi bên của các axit amin tiêu chuẩn, được nêu chi tiết trong danh sách các axit amin tiêu chuẩn, có rất nhiều cấu trúc và tính chất hóa học. Đó là tác động kết hợp của tất cả các chuỗi bên axit amin trong một protein mà cuối cùng sẽ quyết định cấu trúc ba chiều và khả năng phản ứng hóa học của nó. Các axit amin trong chuỗi polipeptit liên kết với nhau bằng liên kết peptit. Sau khi được liên kết trong chuỗi protein, một axit amin riêng lẻ được gọi là phần dư và chuỗi nguyên tử cacbon, nitơ và oxy được liên kết với nhau gọi là chuỗi chính hoặc xương sống của protein.
Hai dạng cộng hưởng
Liên kết peptit có hai dạng cộng hưởng đóng góp một số đặc tính của liên kết đôi và ức chế sự quay quanh trục của nó. Do vậy, các nguyên tử cacbon alpha gần như đồng phẳng. Hai góc nhị diện khác trong liên kết peptit xác định hình dạng cục bộ của khung protein. Phần cuối với một nhóm amino tự do được gọi là đầu tận cùng N hoặc đầu amino, trong khi phần cuối của protein với một nhóm carboxyl tự do được gọi là đầu C hoặc đầu carboxy (trình tự của protein được viết từ đầu N đến đầu C, từ trái sang phải).
Các từ protein, polypeptit, peptit vẫn còn hơi mơ hồ và có thể bị trùng lặp về nghĩa. Protein thường được dùng để chỉ phân tử sinh học hoàn chỉnh có cấu trúc ổn định, trong khi peptit thường được dành cho một oligome axit amin ngắn thường thiếu cấu trúc 3D ổn định. Nhưng ranh giới giữa hai loại này không được xác định rõ và thường nằm gần 20–30 phần còn lại. Polypeptit có thể đề cập đến bất kỳ chuỗi axit amin tuyến tính đơn lẻ nào, thường không phân biệt độ dài, nhưng thường ám chỉ sự vắng mặt của một cấu trúc xác định.
Tương tác
Protein có thể tương tác với nhiều loại phân tử, bao gồm cả với các protein khác, với lipid, với carbohydrate và với DNA.
Sự phong phú trong các tế bào
Người ta ước tính rằng vi khuẩn có kích thước trung bình chứa khoảng 2 triệu protein trên mỗi tế bào (ví dụ: E. coli và Staphylococcus aureus). Các vi khuẩn nhỏ hơn, chẳng hạn như Mycoplasma hoặc xoắn khuẩn chứa ít phân tử hơn, với số lượng từ 50.000 đến 1 triệu. Ngược lại, các tế bào nhân chuẩn lớn hơn và do đó chứa nhiều protein hơn. Ví dụ, các tế bào nấm men đã được ước tính chứa khoảng 50 triệu protein và tế bào người vào khoảng từ 1 đến 3 tỷ.
Nồng độ của các bản sao protein riêng lẻ dao động từ một vài phân tử trên mỗi tế bào cho đến 20 triệu phân tử. Không phải tất cả các gen mã hóa protein đều được biểu hiện trong hầu hết các tế bào và số lượng của chúng phụ thuộc vào, ví dụ, loại tế bào và các kích thích bên ngoài. Trong số khoảng 20.000 protein được mã hóa bởi bộ gen của con người, chỉ có 6.000 protein được phát hiện trong các tế bào lymphoblastoid.
Tổng hợp
Sinh tổng hợp

Riboxom tạo ra protein sử dụng mARN làm khuôn mẫu
Protein được tổng hợp từ các axit amin bằng cách sử dụng thông tin được mã hóa trong gen. Mỗi protein có trình tự axit amin độc đáo của riêng nó, được quy định bởi trình tự nucleotide của gen mã hóa protein này. Mã di truyền là một tập hợp gồm ba nucleotit được gọi là codon và mỗi tổ hợp ba nucleotit chỉ định một axit amin.
Ví dụ AUG (adenine–uracil–guanine) là mã cho methionine. Vì DNA chứa bốn nucleotit nên tổng số codon có thể có là 64. Do đó, có một số dư thừa trong mã di truyền, với một số axit amin được quy định bởi nhiều hơn một codon.
Gen mã hóa
Các gen được mã hóa trong DNA đầu tiên được phiên mã thành RNA tiền truyền tin (mRNA) bởi các protein như RNA polymerase. Hầu hết các sinh vật sau đó xử lý pre-mRNA (còn được gọi là bản phiên mã sơ cấp) bằng cách sử dụng nhiều dạng sửa đổi sau phiên mã khác nhau để tạo thành mARN trưởng thành. mARN này sau đó được sử dụng làm khuôn để tổng hợp protein bởi ribosome.
Ở sinh vật nhân sơ, mARN có thể được sử dụng ngay khi nó được tạo ra hoặc được liên kết bởi một ribosome sau khi di chuyển ra khỏi nucleoid. Ngược lại, sinh vật nhân chuẩn tạo ra mARN trong nhân tế bào, sau đó chuyển vị trí của nó qua màng nhân vào tế bào chất, nơi sau đó quá trình tổng hợp protein diễn ra. Tốc độ tổng hợp protein ở sinh vật nhân sơ cao hơn sinh vật nhân thực và có thể đạt tới 20 axit amin mỗi giây.
Quá trình tổng hợp protein từ khuôn mẫu mRNA được gọi là dịch mã. MRNA được nạp vào ribosome và được đọc ba nucleotit cùng một lúc bằng cách khớp từng codon với bộ ba đối mã bắt cặp của nó nằm trên phân tử RNA vận chuyển. Phân tử này mang axit amin tương ứng với codon mà nó nhận ra.
Chuỗi mới sinh
Enzyme aminoacyl tRNA synthetase “sạc” các phân tử tRNA bằng các axit amin chính xác. Chuỗi polypeptit đang phát triển thường được gọi là chuỗi mới sinh. Protein luôn được sinh tổng hợp từ đầu N đến đầu C.
Kích thước của một protein tổng hợp có thể được đo bằng số lượng axit amin mà nó chứa và bằng tổng khối lượng phân tử của nó, thường được báo cáo bằng đơn vị dalton (đồng nghĩa với đơn vị khối lượng nguyên tử) hoặc đơn vị dẫn xuất kilodalton (kDa).
Kích thước trung bình của protein tăng từ Archaea đến Bacteria đến Eukaryote (283, 311, 438 dư lượng và 31, 34, 49 kDa tương ứng) do số lượng lớn hơn các miền protein cấu thành protein ở các sinh vật bậc cao. Ví dụ, protein men có chiều dài trung bình là 466 axit amin và khối lượng là 53 kDa.
Protein lớn nhất được biết đến là titin, một thành phần của sarcomere cơ với khối lượng phân tử gần 3.000 kDa và tổng chiều dài gần 27.000 axit amin.
Tổng hợp hóa học
Các protein ngắn cũng có thể được tổng hợp về mặt hóa học bằng một nhóm các phương pháp được gọi là tổng hợp peptit, dựa trên các kỹ thuật tổng hợp hữu cơ như liên kết hóa học để tạo ra các peptit với năng suất cao.
Tổng hợp hóa học cho phép đưa axit amin không tự nhiên vào chuỗi polypeptide, chẳng hạn như gắn đầu dò huỳnh quang vào chuỗi bên axit amin. Những phương pháp này rất hữu ích trong hóa sinh phòng thí nghiệm và sinh học tế bào, mặc dù nhìn chung nó không dành cho các ứng dụng thương mại.
Quá trình tổng hợp hóa học không hiệu quả đối với các polypeptit dài hơn khoảng 300 axit amin và các protein được tổng hợp có thể không dễ dàng đảm nhận cấu trúc bậc ba tự nhiên của chúng. Hầu hết các phương pháp tổng hợp hóa học tiến hành từ đầu C đến đầu N, ngược lại với phản ứng sinh học.
Kết cấu của Protein

Cấu trúc tinh thể của chaperonin, một phức hợp protein khổng lồ. Một tiểu đơn vị protein duy nhất được tô sáng. Chaperonin hỗ trợ gấp nếp protein.
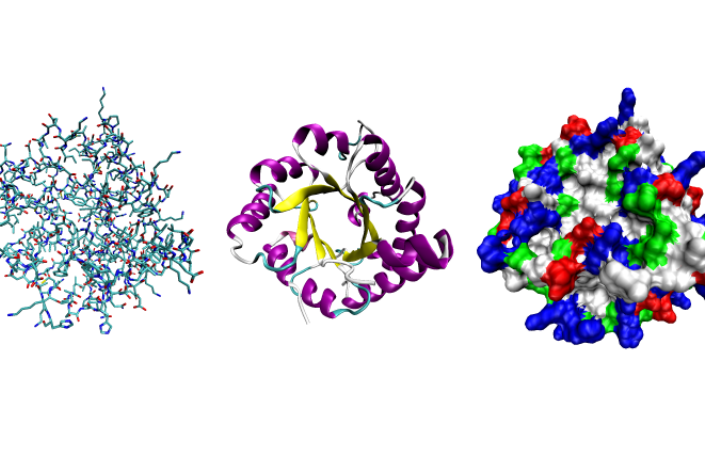
Ba cách biểu diễn về cấu trúc ba chiều của protein triose phosphate isomerase
Ba cách biểu diễn về cấu trúc ba chiều của protein triose phosphate isomerase.
- Trái: Biểu diễn toàn nguyên tử được tô màu theo loại nguyên tử.
- Giữa: Biểu diễn đơn giản hóa minh họa cấu trúc xương sống, được tô màu bởi cấu trúc thứ cấp.
- Phải: Biểu diễn bề mặt tiếp xúc với dung môi được tô màu theo loại cặn (dư axit màu đỏ, dư bazơ màu xanh lam, dư lượng phân cực màu xanh lá cây, dư lượng không phân cực màu trắng).
Cấu trúc 3D
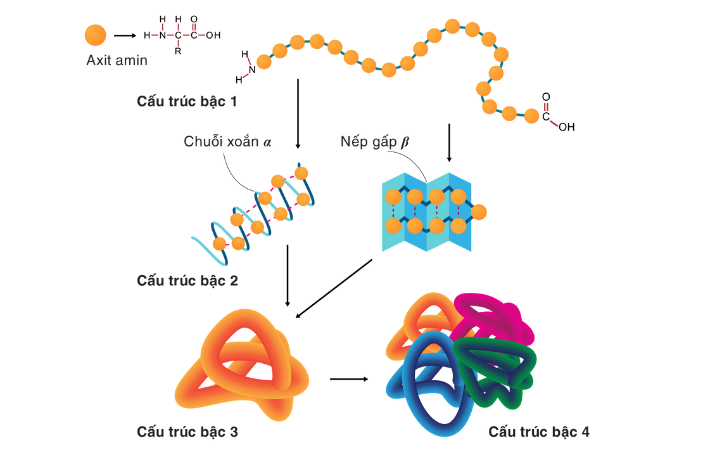
Hầu hết các protein gấp lại thành các cấu trúc 3D độc đáo. Hình dạng mà một protein tự nhiên gấp lại được gọi là cấu tạo tự nhiên của nó. Mặc dù nhiều protein có thể gấp nếp mà không cần sự trợ giúp, chỉ đơn giản thông qua tính chất hóa học của các axit amin của chúng, nhưng một số khác cần sự trợ giúp của các chaperone phân tử để gấp nếp về trạng thái tự nhiên của chúng. Các nhà hóa sinh thường đề cập đến bốn khía cạnh riêng biệt trong cấu trúc của protein.
- Cấu trúc sơ cấp: trình tự axit amin. Protein là poliamit.
- Cấu trúc thứ cấp: thường xuyên lặp lại các cấu trúc cục bộ được ổn định bằng liên kết hydro. Các ví dụ phổ biến nhất là chuỗi xoắn α, β và các vòng xoắn. Vì cấu trúc bậc hai là cục bộ nên nhiều vùng có cấu trúc bậc hai khác nhau có thể có mặt trong cùng một phân tử protein.
- Cấu trúc bậc ba: hình dạng tổng thể của một phân tử protein đơn lẻ, mối quan hệ không gian của các cấu trúc thứ cấp với nhau. Cấu trúc bậc ba thường được ổn định bởi các tương tác không cục bộ, phổ biến nhất là sự hình thành lõi kỵ nước, mà còn thông qua các cầu muối, liên kết hydro, liên kết disulfide và thậm chí cả các sửa đổi sau dịch mã. Thuật ngữ “cấu trúc bậc ba” thường được sử dụng đồng nghĩa với thuật ngữ nếp gấp. Cấu trúc bậc ba là thứ kiểm soát chức năng cơ bản của protein.
- Cấu trúc bậc bốn: cấu trúc được hình thành bởi một số phân tử protein (chuỗi polypeptit), thường được gọi là tiểu đơn vị protein. Nó có chức năng như một phức hợp protein đơn lẻ.
- Cấu trúc bậc năm: dấu hiệu của bề mặt protein tổ chức bên trong tế bào đông đúc. Cấu trúc bậc ba phụ thuộc vào các tương tác đại phân tử thoáng qua nhưng cần thiết xảy ra bên trong các tế bào sống.
Chuyển đổi
Protein không hoàn toàn là các phân tử cứng nhắc. Ngoài các cấp độ cấu trúc này, protein có thể chuyển đổi giữa một số cấu trúc liên quan trong khi chúng thực hiện các chức năng của mình. Trong trường hợp này, các cấu trúc bậc ba hoặc bậc bốn thường được gọi là “sự phù hợp” và sự chuyển đổi giữa chúng được gọi là thay đổi về hình dạng.
Những thay đổi như vậy thường được gây ra bởi sự liên kết của phân tử cơ chất với vị trí hoạt động của enzyme hoặc vùng vật lý của protein tham gia xúc tác hóa học. Trong dung dịch, các protein cũng trải qua sự thay đổi cấu trúc thông qua dao động nhiệt và va chạm với các phân tử khác.

Bề mặt phân tử của một số protein
Bề mặt phân tử của một số protein cho thấy kích thước so sánh của chúng. Từ trái sang phải là: immunoglobulin G (IgG, một kháng thể), huyết sắc tố, insulin (một loại hormone), adenylate kinase (một loại enzyme) và glutamine synthetase (một loại enzyme).
Phân chia
Protein có thể được chia thành ba lớp chính, tương quan với các cấu trúc bậc ba điển hình:
- protein hình cầu
- protein dạng sợi
- protein màng
Hầu như tất cả các protein hình cầu đều hòa tan và nhiều loại là enzyme. Protein dạng sợi thường có cấu trúc, chẳng hạn như collagen, thành phần chính của mô liên kết hoặc keratin, thành phần protein của tóc và móng tay. Protein màng thường đóng vai trò là thụ thể hoặc cung cấp các kênh cho các phân tử phân cực hoặc tích điện đi qua màng tế bào.
Một trường hợp đặc biệt của liên kết hydro nội phân tử trong protein, được bảo vệ kém khỏi sự tấn công của nước và do đó thúc đẩy quá trình khử nước của chính chúng, được gọi là dehydron.
Miền protein
Nhiều protein có một số miền protein, tức là các phân đoạn của protein gấp lại thành các đơn vị cấu trúc riêng biệt. Các miền thường cũng có các chức năng cụ thể, chẳng hạn như các hoạt động enzyme (ví dụ: kinase) hoặc chúng đóng vai trò là các mô-đun liên kết (ví dụ: miền SH3 liên kết với các trình tự giàu proline trong các protein khác).
Motif trình tự
Các trình tự axit amin ngắn trong protein thường đóng vai trò là vị trí nhận biết các protein khác.
Ví dụ, các miền SH3 thường liên kết với họa tiết PxxP ngắn (tức là 2 prolines [P], được phân tách bằng hai axit amin không xác định [x], mặc dù các axit amin xung quanh có thể xác định tính đặc hiệu liên kết chính xác). Nhiều mô típ như vậy đã được thu thập trong cơ sở dữ liệu Eukaryotic Linear Motif (ELM).
Chức năng tế bào
Protein là tác nhân chính trong tế bào, được cho là thực hiện các nhiệm vụ được chỉ định bởi thông tin được mã hóa trong gen.
Ngoại trừ một số loại RNA nhất định, hầu hết các phân tử sinh học khác đều là những nguyên tố tương đối trơ mà protein hoạt động.
Protein chiếm một nửa trọng lượng khô của tế bào Escherichia coli, trong khi các đại phân tử khác như DNA và RNA chỉ chiếm lần lượt là 3% và 20%. Tập hợp các protein biểu hiện trong một tế bào hoặc loại tế bào cụ thể được gọi là hệ protein của nó.

Enzyme hexokinase
Enzym hexokinase được thể hiện dưới dạng mô hình phân tử bóng và dính thông thường. Để chia tỷ lệ ở góc trên cùng bên phải là hai chất nền của nó, ATP và glucose.
Đặc điểm chính
Đặc điểm chính của protein cũng cho phép tập hợp các chức năng đa dạng của chúng là khả năng liên kết các phân tử khác một cách cụ thể và chặt chẽ. Vùng của protein chịu trách nhiệm liên kết với một phân tử khác được gọi là vị trí liên kết và thường là chỗ lõm hoặc “túi” trên bề mặt phân tử. Khả năng liên kết này được trung gian bởi cấu trúc bậc ba của protein. Cấu trúc này xác định túi vị trí liên kết và bởi các tính chất hóa học của chuỗi bên của axit amin xung quanh.
Liên kết protein có thể cực kỳ chặt chẽ và cụ thể. Ví dụ, protein ức chế ribonuclease liên kết với angiogenin của con người với hằng số phân ly dưới phân tử xương đùi (<10 −15 M) nhưng hoàn toàn không liên kết với onconase tương đồng lưỡng cư của nó (>1 M). Những thay đổi hóa học cực kỳ nhỏ chẳng hạn như việc bổ sung một nhóm metyl đơn lẻ vào đối tác liên kết đôi khi có thể đủ để gần như loại bỏ liên kết. Ví dụ, aminoacyl tRNA synthetase đặc trưng cho axit amin valine phân biệt với chuỗi bên rất giống nhau của axit amin isoleucine.
Sự liên kết
Protein có thể liên kết với các protein khác cũng như với các chất nền phân tử nhỏ. Khi các chất đạm liên kết đặc biệt với các bản sao khác của cùng một phân tử, chúng có thể oligome hóa để tạo thành các sợi nhỏ. Quá trình này thường xảy ra trong các chất đạm cấu trúc bao gồm các đơn phân hình cầu tự liên kết để tạo thành các sợi cứng. Các tương tác protein-protein cũng điều chỉnh hoạt động của enzyme, kiểm soát sự tiến triển trong chu kỳ tế bào và cho phép lắp ráp các phức hợp protein lớn thực hiện nhiều phản ứng liên quan chặt chẽ với chức năng sinh học chung.
Protein cũng có thể liên kết hoặc thậm chí được tích hợp vào màng tế bào. Khả năng của các đối tác liên kết để tạo ra những thay đổi về hình dạng trong protein cho phép xây dựng các mạng tín hiệu cực kỳ phức tạp. Vì sự tương tác giữa các protein có thể đảo ngược và phụ thuộc nhiều vào sự sẵn có của các nhóm protein đối tác khác nhau để tạo thành các tập hợp có khả năng thực hiện các bộ chức năng riêng biệt. Do vậy, nghiên cứu về sự tương tác giữa các protein cụ thể là chìa khóa để hiểu các khía cạnh quan trọng của chức năng tế bào và cuối cùng là các thuộc tính phân biệt các loại cụ thể.
Enzym
Vai trò nổi tiếng nhất của chất đạm trong tế bào là các enzym xúc tác các phản ứng hóa học. Enzyme thường có tính đặc hiệu cao và chỉ tăng tốc một hoặc một vài phản ứng hóa học. Enzyme thực hiện hầu hết các phản ứng liên quan đến quá trình trao đổi chất, cũng như điều khiển DNA trong các quá trình như sao chép DNA, sửa chữa DNA và phiên mã.
Một số enzym tác động lên các protein khác để thêm hoặc loại bỏ các nhóm hóa học trong một quá trình được gọi là biến đổi hậu dịch mã. Khoảng 4.000 phản ứng được biết là do enzym xúc tác. Tốc độ tăng tốc do xúc tác enzym tạo ra thường rất lớn, tốc độ tăng gấp 10-17 lần so với phản ứng không được xúc tác trong trường hợp orotate decarboxylase (78 triệu năm không có enzym, 18 mili giây có enzym).
Chú ý
Các phân tử liên kết và hoạt động bởi các enzym được gọi là cơ chất. Mặc dù các enzym có thể bao gồm hàng trăm axit amin, nhưng nó thường chỉ là một phần nhỏ của các gốc tiếp xúc với chất nền, và một phần thậm chí còn nhỏ hơn, trung bình từ ba đến bốn gốc, tham gia trực tiếp vào quá trình xúc tác. Vùng của enzyme liên kết với cơ chất và chứa dư lượng xúc tác được gọi là vị trí hoạt động.
Dirigent protein là thành viên của một nhóm chất đạm quy định hóa học lập thể của một hợp chất được tổng hợp bởi các enzyme khác.

Enzyme
Tín hiệu tế bào và liên kết phối của Protein
Tín hiệu tế bào
Nhiều protein tham gia vào quá trình truyền tín hiệu của tế bào. Một số protein, chẳng hạn như insulin, là các protein ngoại bào truyền tín hiệu từ tế bào nơi chúng được tổng hợp đến các tế bào khác trong các mô ở xa.
Một số khác là các protein màng hoạt động như các thụ thể có chức năng chính là liên kết một phân tử tín hiệu và tạo ra phản ứng sinh hóa trong tế bào. Nhiều thụ thể có một vị trí liên kết lộ ra trên bề mặt tế bào và một miền hiệu ứng bên trong tế bào, có thể có hoạt tính enzym hoặc có thể trải qua một sự thay đổi về hình dạng được phát hiện bởi các protein khác trong tế bào.
Kháng thể
Kháng thể là các thành phần chất đạm của một hệ thống miễn dịch thích ứng có chức năng chính là liên kết các kháng nguyên hoặc chất lạ trong cơ thể và nhắm mục tiêu tiêu diệt chúng. Các kháng thể có thể được tiết ra môi trường ngoại bào hoặc neo đậu trong màng của các tế bào B chuyên biệt được gọi là tương bào.
Trong khi các enzym bị hạn chế về ái lực liên kết với cơ chất do sự cần thiết phải tiến hành phản ứng thì các kháng thể không có những hạn chế như vậy. Ái lực liên kết của một kháng thể với mục tiêu của nó là cực kỳ cao.
Ái lực liên kết
Nhiều protein vận chuyển phối tử liên kết các phân tử sinh học nhỏ cụ thể và vận chuyển chúng đến các vị trí khác trong cơ thể của một sinh vật đa bào. Những protein này phải có ái lực liên kết cao khi phối tử của chúng hiện diện ở nồng độ cao, nhưng cũng phải giải phóng phối tử khi nó hiện diện ở nồng độ thấp trong các mô đích.
Ví dụ điển hình về chất đạm liên kết phối tử là huyết sắc tố, vận chuyển oxy từ phổi đến các cơ quan và mô khác ở tất cả các động vật có xương sống và có các đặc điểm tương đồng gần gũi ở mọi giới sinh học. Lectin là các protein liên kết với đường có tính đặc hiệu cao đối với các gốc đường của chúng. Lectin thường đóng một vai trò trong các hiện tượng nhận dạng sinh học liên quan đến tế bào và protein. Các thụ thể và hormone là những protein liên kết đặc hiệu cao.
Xuyên màng
Protein xuyên màng cũng có thể đóng vai trò là chất đạm vận chuyển phối tử làm thay đổi tính thấm của màng tế bào đối với các phân tử và ion nhỏ. Riêng màng có một lõi kỵ nước mà qua đó các phân tử phân cực hoặc tích điện không thể khuếch tán. Protein màng chứa các kênh bên trong cho phép các phân tử như vậy đi vào và ra khỏi tế bào.
Nhiều protein kênh ion được chuyên biệt hóa để chỉ chọn một ion cụ thể. Ví dụ, các kênh kali và natri thường chỉ phân biệt một trong hai ion.
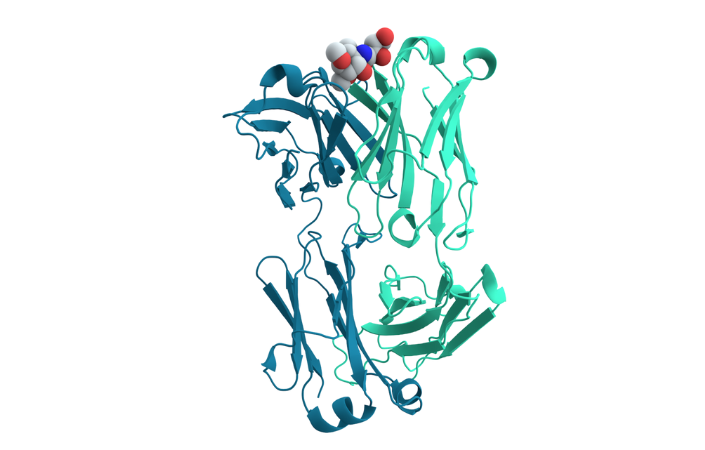
Sơ đồ cấu trúc dải ruy băng
Protein cấu trúc
Các protein cấu trúc tạo ra độ cứng cho các thành phần sinh học lỏng khác. Hầu hết các protein cấu trúc là protein dạng sợi. Ví dụ, collagen và elastin là những thành phần quan trọng của mô liên kết như sụn và keratin được tìm thấy trong các cấu trúc cứng hoặc dạng sợi như tóc, móng tay, lông vũ, móng guốc và một số vỏ động vật.
Một số protein hình cầu cũng có thể đóng vai trò cấu trúc, ví dụ, actin và tubulin có dạng hình cầu và hòa tan dưới dạng đơn phân, nhưng polyme hóa để tạo thành các sợi dài và cứng tạo nên khung tế bào, cho phép tế bào duy trì cấu trúc, hình dáng và kích thước của nó.
Chú ý
Các protein khác phục vụ chức năng cấu trúc là các protein vận động như myosin, kinesin và dynein, chúng có khả năng tạo ra các lực cơ học. Những protein này rất quan trọng đối với khả năng vận động của tế bào sinh vật đơn bào và tinh trùng của nhiều sinh vật đa bào sinh sản hữu tính. Chúng cũng tạo ra các lực tác dụng bằng cách co cơ và đóng vai trò thiết yếu trong vận chuyển nội bào.
Tiến hóa protein
Câu hỏi?
Một câu hỏi quan trọng trong sinh học phân tử là protein tiến hóa như thế nào, tức là làm thế nào đột biến (hay đúng hơn là thay đổi trình tự axit amin) có thể dẫn đến cấu trúc và chức năng mới? Hầu hết các axit amin trong chất đạm có thể được thay đổi mà không làm gián đoạn hoạt động hoặc chức năng, như có thể thấy từ nhiều protein tương đồng giữa các loài (như được thu thập trong cơ sở dữ liệu chuyên biệt cho các họ chất đạm, ví dụ PFAM).
Nhân đôi
Để ngăn chặn những hậu quả nghiêm trọng của đột biến, một gen có thể được nhân đôi trước khi nó đột biến tự do. Tuy nhiên, điều này cũng có thể dẫn đến mất hoàn toàn chức năng của gen và do đó tạo ra các gen giả. Thông thường, những thay đổi đơn axit amin có hậu quả hạn chế mặc dù một số có thể thay đổi đáng kể chức năng của protein, đặc biệt là trong các enzym. Ví dụ, nhiều enzym có thể thay đổi tính đặc hiệu cơ chất của chúng bằng một hoặc một vài đột biến.
Chú ý
Những thay đổi về tính đặc hiệu của cơ chất được tạo điều kiện thuận lợi bởi tính lộn xộn của cơ chất, tức là khả năng của nhiều enzyme liên kết và xử lý nhiều cơ chất. Khi đột biến xảy ra, tính đặc hiệu của enzyme có thể tăng (hoặc giảm) và do đó nó kích hoạt enzyme. Như vậy, vi khuẩn (hoặc các sinh vật khác) có thể thích nghi với các nguồn thức ăn khác nhau, kể cả các chất nền không tự nhiên như nhựa.
Phương pháp nghiên cứu
Các hoạt động và cấu trúc của chất đạm có thể được kiểm tra bằng in vitro, in vivo và in silico. Các nghiên cứu in vitro về protein tinh khiết trong môi trường được kiểm soát rất hữu ích cho công việc tìm hiểu cách protein thực hiện chức năng của nó.
Ví dụ, nghiên cứu động học enzyme khám phá cơ chế hóa học của hoạt động xúc tác của enzyme và ái lực tương đối của nó đối với các phân tử cơ chất khác nhau. Ngược lại, các thí nghiệm in vivo có thể cung cấp thông tin về vai trò sinh lý của protein trong bối cảnh tế bào hoặc thậm chí toàn bộ sinh vật. Trong các nghiên cứu silico sử dụng phương pháp tính toán để nghiên cứu protein.
Thanh lọc protein
Tinh chế
Để thực hiện phân tích trong ống nghiệm, protein phải được tinh chế khỏi các thành phần tế bào khác. Quá trình này thường bắt đầu bằng quá trình ly giải tế bào, trong đó màng tế bào bị phá vỡ và các thành phần bên trong được giải phóng thành một dung dịch được gọi là dịch ly giải thô.
Hỗn hợp thu được sẽ được tinh chế bằng siêu ly tâm, giúp phân đoạn các thành phần tế bào khác nhau thành các phần chứa chất đạm hòa tan; lipid màng và protein; bào quan tế bào và axit nuclêic. Kết tủa bằng một phương pháp gọi là tách muối có thể cô đặc các protein từ dịch ly giải này.
Sau đó, các loại sắc ký sẽ được sử dụng để phân lập protein hoặc các protein dựa trên các đặc tính như
- trọng lượng phân tử
- điện tích thực
- ái lực liên kết
Mức độ tinh sạch
Mức độ tinh sạch được theo dõi bằng cách sử dụng nhiều loại điện di trên gel nếu biết trọng lượng phân tử và điểm đẳng điện của protein mong muốn, bằng phương pháp quang phổ nếu protein có các đặc điểm quang phổ có thể phân biệt hoặc bằng xét nghiệm enzyme nếu protein có hoạt tính enzyme.
Ngoài ra, các protein sẽ được phân lập tùy theo điện tích của chúng bằng cách sử dụng kỹ thuật lấy nét điện.
Đối với các chất đạm tự nhiên, một loạt các bước tinh chế sẽ được sử dụng để thu protein tinh khiết cho các ứng dụng trong phòng thí nghiệm. Để đơn giản hóa quy trình này, kỹ thuật di truyền thường được sử dụng để bổ sung các đặc tính hóa học cho protein giúp chúng dễ dàng tinh sạch mà không ảnh hưởng đến cấu trúc hoặc hoạt động của chúng.
Chú ý
Ở đây, một “thẻ” bao gồm một trình tự axit amin cụ thể, thường là một loạt gốc histidine, được gắn vào đầu cuối của protein. Kết quả là, khi dịch ly giải được truyền qua cột sắc ký có chứa niken, phần histidine dư sẽ buộc niken và gắn vào cột trong khi các thành phần không được đánh dấu của dịch ly giải đi qua mà không bị cản trở. Một số thẻ khác đã được phát triển để giúp các nhà nghiên cứu tinh chế các protein cụ thể khỏi các hỗn hợp phức tạp.
Nội hóa tế bào
Nghiên cứu
Nghiên cứu về protein in vivo thường liên quan đến quá trình tổng hợp và định vị chất đạm trong tế bào.
Mặc dù nhiều protein nội bào được tổng hợp trong tế bào chất và các protein liên kết màng hoặc được tiết ra trong mạng lưới nội chất, nhưng các chi tiết cụ thể về cách protein tác động đến các bào quan hoặc cấu trúc tế bào cụ thể thường không rõ ràng.
Một kỹ thuật hữu ích để đánh giá quá trình định vị tế bào sử dụng kỹ thuật di truyền để biểu hiện trong tế bào một protein dung hợp hoặc thể khảm bao gồm protein tự nhiên cần quan tâm được liên kết với một “trình báo cáo” chẳng hạn như protein phát huỳnh quang màu lục (GFP). Vị trí của protein hợp nhất trong tế bào sẽ được hiển thị rõ ràng và hiệu quả bằng kính hiển vi.
Phương pháp
Các phương pháp để làm sáng tỏ vị trí tế bào của protein yêu cầu việc sử dụng các dấu hiệu ngăn đã biết cho các vùng như ER, Golgi, lysosome hoặc không bào, ty thể, lục lạp, màng sinh chất,…
Với việc sử dụng các phiên bản được đánh dấu huỳnh quang của dấu hiệu này hoặc của các kháng thể đối với các dấu hiệu đã biết, việc xác định vị trí của một protein đáng chú ý trở nên đơn giản hơn nhiều. Ví dụ, miễn dịch huỳnh quang gián tiếp sẽ cho phép tập trung huỳnh quang và chứng minh vị trí. Thuốc nhuộm huỳnh quang được sử dụng để đánh dấu các ngăn tế bào với mục đích tương tự.
Các khả năng khác
Các khả năng khác cũng tồn tại. Ví dụ, hóa mô miễn dịch thường sử dụng kháng thể đối với một hoặc nhiều protein quan tâm được liên hợp với enzyme tạo ra tín hiệu phát quang hoặc tạo màu có thể được so sánh giữa các mẫu, cho phép thông tin định vị.
Một kỹ thuật có thể áp dụng khác là đồng phân đoạn trong gradient sucrose (hoặc vật liệu khác) bằng cách sử dụng ly tâm isopycnic. Mặc dù kỹ thuật này không chứng minh được sự tập trung của một ngăn có mật độ đã biết và chất đạm được chú ý, nhưng nó làm tăng khả năng xảy ra và phù hợp hơn với các nghiên cứu quy mô lớn.
Kết luận
Cuối cùng, phương pháp định vị tế bào tiêu chuẩn vàng là kính hiển vi điện tử miễn dịch.
Kỹ thuật này cũng sử dụng kháng thể đối với protein quan tâm, cùng với các kỹ thuật kính hiển vi điện tử cổ điển. Mẫu được chuẩn bị để kiểm tra bằng kính hiển vi điện tử bình thường, sau đó được xử lý bằng một kháng thể với protein đáng chú ý được liên hợp với một vật liệu cực kỳ đậm đặc điện, thường là vàng. Điều này cho phép nội hóa cả các chi tiết siêu cấu trúc cũng như protein đáng chú ý.
Thông qua một ứng dụng kỹ thuật di truyền khác được gọi là đột biến định hướng tại chỗ, các nhà nghiên cứu có thể thay đổi trình tự protein và do đó thay đổi cấu trúc, định vị tế bào và tính nhạy cảm với quy định của nó. Kỹ thuật này thậm chí còn cho phép kết hợp các axit amin không tự nhiên vào protein, sử dụng tRNA biến đổi, và có thể cho phép thiết kế hợp lý các protein mới với các đặc tính mới.
Proteomic
Tổng số protein bổ sung có mặt tại một thời điểm trong một tế bào hoặc loại tế bào được gọi là hệ protein. Nghiên cứu về các bộ dữ liệu quy mô lớn như vậy xác định lĩnh vực proteomic. Nó được đặt tên tương tự như lĩnh vực gen liên quan.
Các kỹ thuật thí nghiệm chính trong proteomic bao gồm điện di 2D cho phép tách nhiều protein, khối phổ cho phép xác định nhanh chóng thông lượng cao của protein và giải trình tự peptit (thường là sau quá trình tiêu hóa trong gel), protein microarrays cho phép phát hiện mức độ tương đối của các loại protein khác nhau có trong một tế bào và sàng lọc two-hybrid cho phép khám phá một cách có hệ thống các tương tác protein-protein.
Tổng số bổ sung của các tương tác như vậy có thể có về mặt sinh học được gọi là bộ tương tác. Một nỗ lực có hệ thống để xác định cấu trúc của protein đại diện cho mọi nếp gấp có thể được gọi là bộ gen cấu trúc.
Xác định cấu trúc
Khám phá cấu trúc Protein
Khám phá cấu trúc bậc ba của protein, hoặc cấu trúc bậc bốn của các phức hợp của nó sẽ cung cấp manh mối quan trọng về cách protein thực hiện chức năng của mình và cách nó có thể bị ảnh hưởng. Vì các protein quá nhỏ nên khó nhìn thấy dưới kính hiển vi ánh sáng nên các phương pháp khác phải được sử dụng để xác định cấu trúc của chúng. Các phương pháp thí nghiệm phổ biến bao gồm tinh thể học tia X và quang phổ NMR.
Cả hai đều có thể tạo ra thông tin cấu trúc ở độ phân giải nguyên tử. Tuy nhiên, các thí nghiệm NMR có thể cung cấp thông tin mà từ đó có thể ước tính một tập hợp con khoảng cách giữa các cặp nguyên tử và sự phù hợp cuối cùng có thể có đối với protein được xác định bằng cách giải một bài toán hình học khoảng cách. Giao thoa kế phân cực kép là một phương pháp phân tích định lượng để đo cấu trúc protein tổng thể và sự thay đổi về hình dạng do tương tác hoặc kích thích khác.
Lưỡng sắc tròn Protein
Lưỡng sắc tròn là một kỹ thuật phòng thí nghiệm khác để xác định thành phần bên trong β-tấm / xoắn ốc α của protein. Kính hiển vi điện tử lạnh được sử dụng để tạo ra thông tin cấu trúc có độ phân giải thấp hơn về các phức hợp protein lớn, bao gồm cả virus đã được lắp ráp. Một biến thể được gọi là tinh thể học điện tử cũng có thể tạo ra thông tin có độ phân giải cao trong một số trường hợp, đặc biệt đối với các tinh thể hai chiều của protein màng.
Các cấu trúc đã giải quyết thường được gửi vào Ngân hàng Dữ liệu Protein (PDB), một nguồn tài nguyên miễn phí mà từ đó bạn có thể thu thập dữ liệu cấu trúc về hàng nghìn protein ở dạng tọa độ Descartes cho từng nguyên tử trong protein. ư
Trình tự gen
Nhiều trình tự gen được biết đến hơn cấu trúc chất đạm. Hơn nữa, tập hợp các cấu trúc được giải quyết thiên về các protein có thể dễ dàng tuân theo các điều kiện cần thiết trong tinh thể học tia X, một trong những phương pháp xác định cấu trúc chính.
Đặc biệt, protein hình cầu tương đối dễ kết tinh để chuẩn bị cho tinh thể học tia X. Ngược lại, protein màng và phức hợp protein lớn rất khó kết tinh và được trình bày dưới mức trong PDB. Các sáng kiến về bộ gen cấu trúc đã cố gắng khắc phục những thiếu sót này bằng cách giải quyết một cách có hệ thống các cấu trúc đại diện của các lớp nếp gấp chính. Các phương pháp dự đoán cấu trúc protein cố gắng cung cấp phương tiện tạo ra cấu trúc hợp lý cho các protein có cấu trúc chưa được xác định bằng thực nghiệm.
Dự đoán cấu trúc

Dự đoán cấu trúc
Các axit amin cấu thành sẽ được phân tích để dự đoán cấu trúc Protein bậc hai, bậc ba và bậc bốn, trong trường hợp này là huyết sắc tố chứa các đơn vị heme
Bổ sung cho lĩnh vực bộ gen cấu trúc, dự đoán cấu trúc chất đạm phát triển các mô hình toán học hiệu quả của protein để dự đoán bằng máy tính sự hình thành phân tử trong lý thuyết, thay vì phát hiện cấu trúc bằng quan sát trong phòng thí nghiệm. Loại dự đoán cấu trúc thành công nhất, được gọi là mô hình hóa tương đồng, dựa vào sự tồn tại của cấu trúc “mẫu” có trình tự tương tự với protein được mô hình hóa.
Mục tiêu
Mục tiêu của bộ gen cấu trúc là cung cấp đủ đại diện trong các cấu trúc đã giải quyết để mô hình hóa hầu hết các cấu trúc còn lại. Mặc dù việc tạo ra các mô hình chính xác vẫn là một thách thức khi chỉ có sẵn các cấu trúc mẫu có liên quan ở xa, nhưng có ý kiến cho rằng việc căn chỉnh trình tự là nút cổ chai trong quá trình này, vì các mô hình khá chính xác có thể được tạo ra nếu biết được sự căn chỉnh trình tự “hoàn hảo”.
Nhiều phương pháp dự đoán cấu trúc đã phục vụ cho lĩnh vực kỹ thuật protein mới nổi, trong đó các nếp gấp protein mới đã được thiết kế. Ngoài ra, các protein (ở sinh vật nhân chuẩn ~33%) chứa các phân đoạn lớn không có cấu trúc nhưng có chức năng sinh học và có thể được phân loại là các protein bị rối loạn nội tại. Do đó, dự đoán và phân tích rối loạn protein là một phần quan trọng của đặc tính cấu trúc chất đạm.
Tin sinh học Protein
Một loạt các phương pháp tính toán đã được phát triển để phân tích cấu trúc, chức năng và sự tiến hóa của protein. Sự phát triển của những công cụ như vậy đã được thúc đẩy bởi một lượng lớn dữ liệu bộ gen và protein có sẵn cho nhiều loại sinh vật, bao gồm cả bộ gen của con người.
Đơn giản là không thể nghiên cứu tất cả các protein bằng thực nghiệm, do đó chỉ một số ít được đưa vào thí nghiệm trong khi các công cụ tính toán được sử dụng để ngoại suy cho các chất đạm tương tự. Các protein tương đồng như vậy có thể được xác định một cách hiệu quả ở các sinh vật có họ hàng xa bằng cách sắp xếp trình tự.
Bộ Gen
Bộ gen và trình tự gen có thể được tìm kiếm bằng nhiều công cụ cho các thuộc tính nhất định.
Các công cụ lập hồ sơ trình tự có thể tìm thấy:
- các vị trí enzyme cắt giới hạn
- mở các khung đọc trong trình tự nucleotide
- dự đoán các cấu trúc thứ cấp
Cây phát sinh gen có thể được xây dựng và các giả thuyết tiến hóa được phát triển bằng cách sử dụng phần mềm đặc biệt như ClustalW liên quan đến tổ tiên của các sinh vật hiện đại và các gen mà chúng biểu hiện. Lĩnh vực tin sinh học hiện nay không thể thiếu việc phân tích gen và protein.
Trong mô phỏng Silico của các quá trình động lực học
Một vấn đề tính toán phức tạp hơn là dự đoán các tương tác giữa các phân tử, chẳng hạn như trong
- Sự kết hợp phân tử
- Sự gấp nếp protein
- Tương tác protein-protein
- Phản ứng hóa học
Các mô hình toán học để mô phỏng các quá trình động học này liên quan đến cơ học phân tử, cụ thể là động lực học phân tử.
Về vấn đề này, trong các mô phỏng silico đã phát hiện ra sự gấp nếp của các vùng protein xoắn ốc α nhỏ như đầu lông nhung mao, chất đạm phụ kiện HIV và các phương pháp lai kết hợp động lực học phân tử tiêu chuẩn với toán học cơ học lượng tử đã khám phá các trạng thái điện tử của rhodopsin.
Động lực học lượng tử
Ngoài động lực học phân tử cổ điển, các phương pháp động lực học lượng tử cho phép mô phỏng chất đạm ở mức độ chi tiết nguyên tử với mô tả chính xác các hiệu ứng cơ học lượng tử. Các ví dụ bao gồm phương pháp Hartree (MCTDH) đa cấu hình nhiều lớp và phương pháp tiếp cận phương trình chuyển động phân cấp (HEOM), đã được áp dụng cho các phức hợp thu hoạch ánh sáng và vi khuẩn tương ứng.
Cả mô phỏng cơ học lượng tử và cổ điển của các hệ thống quy mô sinh học đều đòi hỏi tính toán cực kỳ cao, do đó, các sáng kiến điện toán phân tán (ví dụ: dự án Folding@home) tạo điều kiện thuận lợi cho mô hình phân tử bằng cách khai thác các tiến bộ trong xử lý song song GPU và kỹ thuật Monte Carlo.
Phân tích hóa học của Protein
Hàm lượng nitơ tổng của chất hữu cơ được hình thành chủ yếu bởi các nhóm amin trong chất đạm. Tổng Nitơ Kjeldahl (TKN) là thước đo nitơ được sử dụng rộng rãi trong phân tích nước (chất thải), đất, thực phẩm, thức ăn chăn nuôi và chất hữu cơ nói chung. Đúng như tên gọi, phương pháp Kjeldahl được áp dụng. Các phương pháp nhạy cảm hơn cũng được áp dụng.
Dinh dưỡng của Protein
Phần 1
Hầu hết các vi sinh vật và thực vật có thể sinh tổng hợp tất cả 20 axit amin tiêu chuẩn, trong khi động vật (bao gồm cả con người) phải lấy một số axit amin từ ăn uống. Các axit amin mà một sinh vật không thể tự tổng hợp được gọi là axit amin thiết yếu.
Các enzym quan trọng tổng hợp một số axit amin không có ở động vật chẳng hạn như aspartokinase, xúc tác bước đầu tiên trong quá trình tổng hợp lysine, methionine và threonine từ aspartate. Nếu axit amin có mặt trong môi trường, vi sinh vật có thể bảo tồn năng lượng bằng cách hấp thụ axit amin từ môi trường xung quanh và điều hòa giảm quá trình sinh tổng hợp của chúng.
Động vật
Ở động vật, axit amin thu được thông qua việc tiêu thụ thực phẩm có chứa chất đạm. Các protein ăn vào sau đó được phân hủy thành các axit amin thông qua quá trình tiêu hóa, thường liên quan đến sự biến tính của chất đạm khi tiếp xúc với axit và thủy phân bởi các enzyme gọi là protease.
Một số axit amin ăn vào được sử dụng cho quá trình sinh tổng hợp protein, trong khi một số khác được chuyển đổi thành glucose thông qua quá trình tân tạo glucose hoặc được đưa vào chu trình axit xitric. Việc sử dụng protein làm nhiên liệu này đặc biệt quan trọng trong điều kiện đói vì nó cho phép sử dụng các protein của chính cơ thể để hỗ trợ sự sống, đặc biệt là các protein được tìm thấy trong cơ bắp.
Phần 2
Ở động vật như chó và mèo, chất đạm duy trì sức khỏe và chất lượng của da bằng cách thúc đẩy sự phát triển và sừng hóa của nang lông, do đó làm giảm khả năng các vấn đề về da tạo ra mùi khó chịu.
Chất đạm kém chất lượng cũng có vai trò liên quan đến sức khỏe đường tiêu hóa, làm tăng khả năng gây đầy hơi và các hợp chất có mùi ở chó vì khi chất đạm đến ruột kết ở trạng thái không tiêu hóa được, chúng sẽ bị lên men tạo ra khí hydro sunfua, indole và skatole.
Chú ý
Chó và mèo tiêu hóa chất đạm động vật tốt hơn chất đạm từ thực vật, nhưng các sản phẩm có nguồn gốc động vật chất lượng thấp sẽ được tiêu hóa kém, bao gồm da, lông và mô liên kết.
Trên đây là những thông tin chi tiết về chất đạm. Mela hy vọng rằng những thông tin này sẽ giúp bạn hiểu rõ hơn về loại dưỡng chất mà bạn đang nạp vào cơ thể.
Mela – Tốt như mẹ làm